Modelos
atómicos y partículas subatómicas.
Modelo
atómico.
Un modelo atómico es una representación estructura, que trata de
explicar su comportamiento y propiedades. También debe de tener su diagrama
conceptual de su funcionamiento. Entre más tiempo se fue mejorando los modelos,
como los siguientes de cada científico
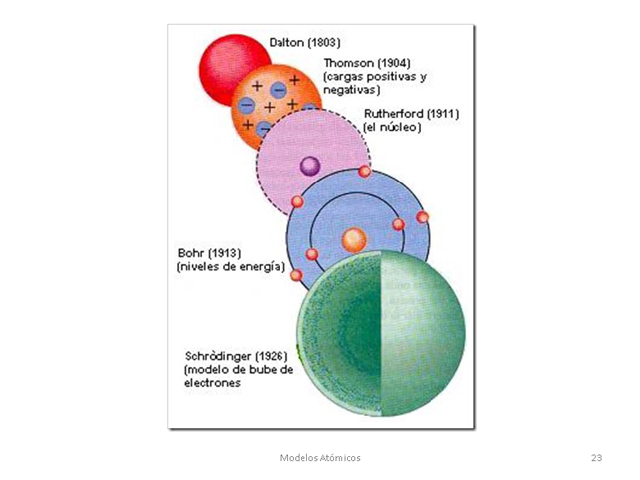
Modelo atómico de Demócrito, el primer modelo atómico Modelo
atómico de Dalton, que surgió en el contexto de la química, el primero con
bases científicas. (1803)
Modelo atómico de Thomson donde los electrones son como las
"frutas" dentro de una "masa" positiva. (1904)
Modelo del átomo cúbico de Lewis, que explica la teoría de la
valencia.
Modelo atómico de Rutherford, el primero que distingue entre el
núcleo central y una nube de electrones a su alrededor. (1911)
Modelo atómico de Bohr, con electrones girando en órbitas
circulares. (1913)
Modelo atómico de Sommerfeld, una versión del modelo de
Rutherford-Bohr.
Modelo atómico de Schrödinger, los electrones se consideran
ondas de materia existente.
Partículas
subatómicas.
El descubrimiento de la estructura
interna de protones y neutrones, reveló que estas eran partículas compuestas.
Protón: Se
encuentra en el núcleo. Tiene carga positiva igual en magnitud a la carga del
electrón. El número atómico de un elemento indica el número de protones que tiene
en el núcleo.
Neutrones: Se
encuentra en el núcleo. Su masa es casi igual que la del protón. No posee carga
eléctrica.
Electrón:
Se encuentra
en la corteza. Y tiene una masa media.
Nuvia Pamela Yañez Estrada.

No hay comentarios.:
Publicar un comentario